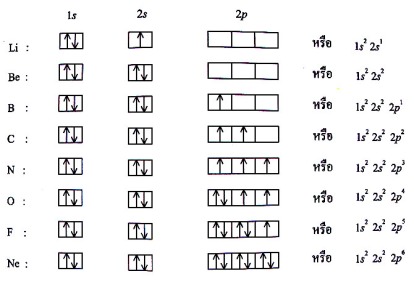
1.1.1 ประเภทของสารเคมี
สารเคมีมีหลายประเภท แต่ละประเภทมีสมบัติต่างกัน สารเคมีจึงจำเป็นต้องมีฉลากที่มีข้อมูลเกี่ยวกับความเป็นอันตรายของตัวมันเองเพื่อความปลอดภัยในการจัดเก็บ การนำไปใช้ และการกำจัด โดยฉลากควรมีข้อมูลดังนี้
- ชื่อผลิตภัณฑ์
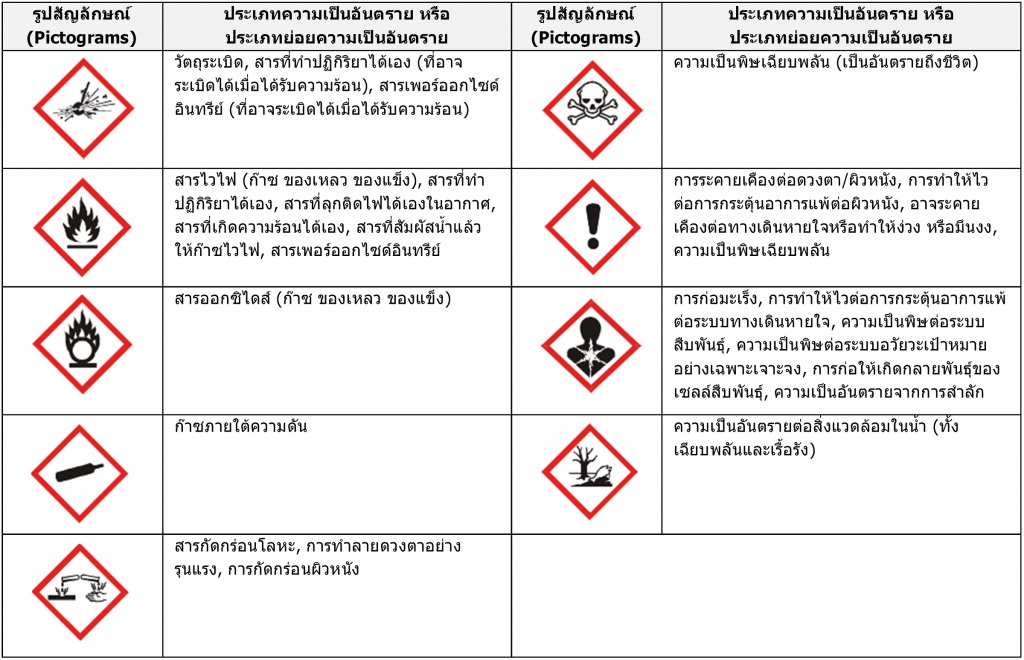
- รูปสัญลักษณ์ แสดงความเป็นอัตรายของสารเคมี
- คำเตือน ข้อมูลความเป็นอันตราย และข้อควรระวัง
- ข้อมูลของบริษัทผู้ผลิตสารเคมี
และควรมีสัญลักษณ์แสดงความเป็นอันตรายด้วย
ตัวอย่างสัญลักษณ์แสดงความเป็นอันตรายในระบบ GHS
ตัวอย่างสัญลักษณ์แสดงความเป็นอันตรายในระบบ NFPA
1.1.2 ข้อควรปฏิบัติในการทำปฏิบัติการเคมี
ก่อนทำปฏิบัติการ
1) ศึกษาขั้นตอนหรือวิธีการทำปฏิบัติการให้เข้าใจ วางแผนการทดลอง หากมีข้อสงสัยให้สอบถามก่อน ทดลอง
2) ศึกษาข้อมูลของสารที่ใช้ทดลอง เทคนิคการใช้เครื่องมือ วัสดุอุปกรณ์รวมถึงวิธีการทดลองที่ถูกต้อง
3) แต่งกายให้เหมาะสม
ขณะปฏิบัติการ
1) ข้อปฏิบัติโดยทั่วไป
1.1 สวมแว่นตานิรภัย ติดกระดุมเสื้อคลุมทุกเม็ด สวมถุงมือเมื่อใช้สารกัดกร่อนหรือสารอันตราย สวมผ้าปิดปากเมื่อใช้สารเคมีที่มีไอระเหย และทำการปฏิบัติการในที่ซึ่งอากาศถ่ายเทหรือใน
ตู้ดูดควัน
1.2 ห้ามรับประทานอาหารและเครื่องดื่มหรือทำกิจกรรมอื่นๆที่ไม่เกี่ยวข้องกับการปฏิบัติการ
1.3 ไม่ทำการทดลองตามลำพัง
1.4 ไม่เล่นและไม่รบกวนผู้อื่นขณะทำการปฏิบัติการ
1.5 ทำตามขั้นตอนและวิธีการอย่างเคร่งครัด
1.6 ไม่ปล่อยให้อุปกรณ์ให้ความร้อนทำงานโดยไม่มีคนดูแล
2) ข้อปฏิบัติในการใช้สารเคมี
2.1 อ่านชื่อสารเคมีบนฉลากให้แน่ใจก่อนใช้
2.2 เคลื่อนย้าย แบ่ง ถ่ายเท สารเคมีด้วยความระมัดระวัง
2.3 หันปากหลอดทดลองออกจากตัวเองและผู้อื่นเสมอ
2.4 ห้ามชิมหรือสูดดมสารเคมีโดยตรง
2.5 การเจือจางกรด ให้เทกรดลงน้ำ
2.6 ไม่เทสารเคมีที่เหลือจากการเทหรือตักออกจากขวดลงขวดเดิมโดยเด็ดขาด
2.7 เมื่อสารเคมีหกเล็กน้อยให้กวาดหรือเช็ดแต่ถ้าหกมากให้แจ้งครูผู้สอน
หลังปฏิบัติการ
1) ทำความสะอาดอุปกรณ์รวมทั้งทำความสะอาดโต๊ะปฏิบัติการ
2) ถอดอุปกรณ์ป้องกันอัตรายก่อนออกจากห้อง
1.1.3 การกำจัดสารเคมี
1) สารเคมีที่ละลายน้ำได้และมี pH เป็นกลาง ปริมาณไม่เกิน 1 ลิตรสามารถเททิ้งลงอ่างน้ำได้
2) สารละลายเข้มข้นบางชนิดควรเจือจางก่อนเทลงอ่างน้ำ ถ้าปริมาณมากต้องทำให้เป็นกลางก่อน
3) สารที่เป็ของแข็งไม่อันตรายไม่เกิน 1 กิโลกรัม สามารถใส่ภาชนะปิดมิดติดฉลากให้ชัดเจนและทิ้งใน
ที่ซึ่งเตรียมไว้ได้เลย
4) สารไวไฟ ตัวทำลำลายไม่ละลายน้ำ สารประกอบของโลหะเป็นพิษหรือสารที่ทำปฏิกิริยากับน้ำห้ามทิ้ง
ลงอ่างน้ำ