3.2.1 การเกิดพันธะไอออนิก
พันธะไอออนิก
พันธะไอออนิก(Ionic bond) คือ แรงยึดเหนี่ยวที่เกิดในสาร โดยที่อะตอมของธาตุที่มีค่าพลังงานไอออไนเซชันต่ำ ให้เวเลนต์อิเล็กตรอนแก่อะตอมของธาตุที่มีค่าพลังงานไอออนไนเซชันสูง กลายเป็นไอออนที่มีประจุบวกและประจุลบ เมื่อไอออนทั้งสองเข้ามาอยู่ใกล้กันจะเกิดแรงดึงดูดทางไฟฟ้าที่แข็งแรงระหว่างประจุไฟฟ้าตรงข้ามเหล่านั้น ทำให้ไอออนทั้งสองยึดเหนี่ยวกันด้วย พันธะเคมีที่เรียกว่า “พันธะไอออนิก”
ตัวอย่างเช่นโครงสร้างของผลึกโซเดียมคลอไรด์เป็นของแข็ง รูปลูกบาศก์ ใสไม่มีสีในผลึก มีโซเดียมไอออนสลับกับคลอไรด์ไอออน เป็นแถว ๆ ทั้งสามมิติ มีลักษณะคล้ายตาข่าย โดยที่แตละไอออนจะมีไอออนต่างชนิดล้อมรอบอยู่ 6 ไอออน ดังรูป 2 รูป ข้างล่างดังนี้
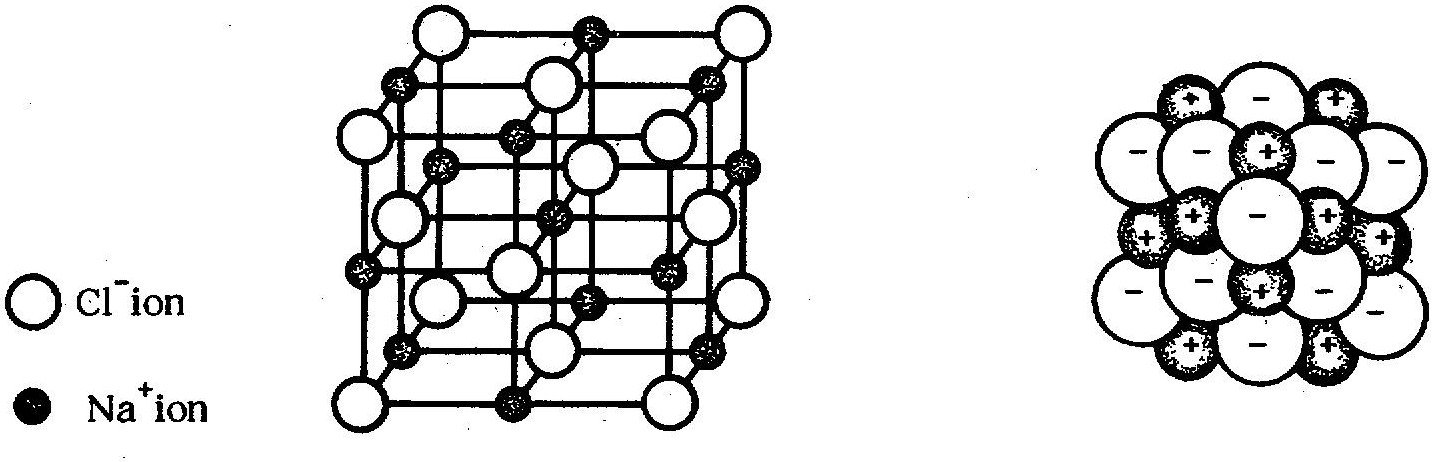

เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ และอโลหะมีค่าพลังงานไอออไนเซชันสูง ดังนั้นพันธะไอออนิกจึงเกิดระหว่างธาตุโลหะ และอโลหะได้ดี กล่าวคือ อะตอมของโลหะให้เวเลนต์อิเล็กตรอนกับอะตอมของอโลหะ แล้วเกิดไอออนบวกของโลหะ และไอออนลบของอโลหะ ไอออนทั้งสองจะส่งแรงดึงดูดระหว่างประจุบวกและลบ เกิดเป็นพันธะไอออนิก
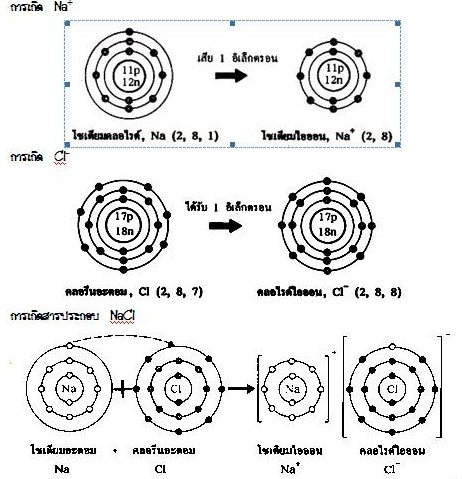
และการที่โลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ เพื่อปรับให้มีเวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน ไอออนบวกกับไอออนลบจึงดึงดูดกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเกิดเป็นสารประกอบไอออนิก (Ionic compound) ดังนี้
การเกิดสารประกอบโซเดียมคลอไรด์ (NaCl) จากโซเดียม (Na) และ คลอรีน (Cl)
3.2.2 สูตรเคมีและชื่อของสารประกอบไอออนิก
การเขียนสูตรสารประกอบไอออนิก ใช้หลักดังนี้
1. เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบของอโลหะหรือกลุ่มไอออนลบ
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหาตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของแต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวาล่าง
การอ่านชื่อสารประกอบไอออนิก
1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
อออซิเจน เปลี่ยนเป็น ออกไซด์ (oxide) | ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride) |
| คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride) | ไอโอดีน เปลี่ยนเป็น ไอโอไดด์ (iodide) |
ตัวอย่างการอ่านชื่อสารประกอบไอออนิกธาตุคู่
| NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr) | CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide) |
| KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide) | CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride) |
ถ้าสารประกอบที่เกิดจากธาตุโลหะเดีนวกันที่มีไอออนได้หลายชนิด รวมตัวกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวกแล้วตามด้วยค่าประจุของไอออนของโลหะโดยวงเล็บเป็นเลขโรมัน แล้วตามด้วยอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น Fe เกิดไอออนได้ 2 ชนิดคือ Fe 2+ และ Fe 3+ และCu เกิดอิออนได้ 2 ชนิดคือ Cu + และ Cu 2+ สารประกอบที่เกิดขึ้นและการอ่านชื่อ ดังนี้
| FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II) chloride ) | CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I) sunfide ) |
| FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron (III) chloride ) | Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์ ( Copper (II) sunfide ) |
2. สารประกอบธาตุสามหรือมากกว่า ถ้าสารประกอบเกิดจากไอออนบวกของโลหะ หรือกลุ่มไอออนบวกรวมตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
| CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonat) | KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae) |
| Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide) | (NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium pospate) |

ไม่มีความคิดเห็น:
แสดงความคิดเห็น